RECOMMANDATIONS
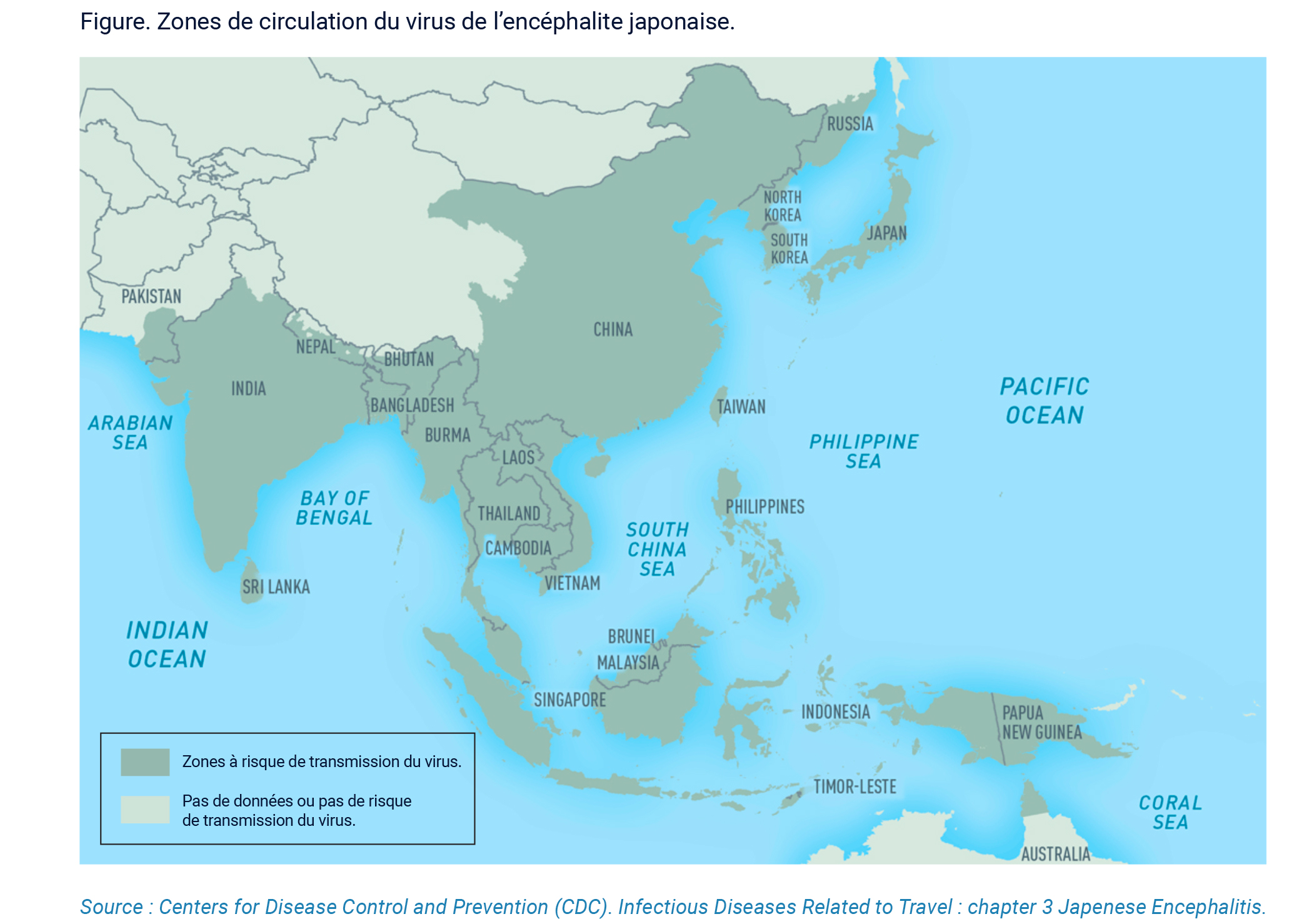
La maladie est rare chez les voyageurs. La vaccination contre l’encéphalite japonaise n’est donc pas recommandée systématiquement pour tous les voyages en Asie ou en Océanie. Elle est toutefois recommandée aux personnes âgées de 2 mois et plus en cas :
- de séjour en milieu rural (quelle qu’en soit la durée) dans une région endémique avec exposition importante (plus particulièrement dans les zones rurales où l’irrigation par inondation est pratiquée (rizières), à proximité d’élevages de porcs, en période d’épidémie (ou de circulation accrue du virus chez l’animal). Les situations suivantes sont considérées à risque : nuit passée à la belle étoile sans moustiquaire, camping, travail à l’extérieur, cyclisme, randonnée, etc.) ;
- d’expatriation dans un pays situé dans la zone de circulation du virus ;
- toute autre situation jugée à risque par le médecin.
Il est important de rappeler à tous les voyageurs de prendre des mesures individuelles de protection contre les piqûres de moustiques (vêtements couvrants imprégnés d’insecticide, moustiquaires, répulsifs cutanés – voir tableau ci-dessous).
Télécharger et imprimer le tableau
SCHÉMA DE VACCINATION
Le vaccin ne peut être administré avant le 2e mois de vie.
Enfants
Enfants âgés de 2 mois à moins de 3 ans
- 2 doses de 0,25 ml espacées de quatre semaines (J0 et J28) ;
- 1 dose de rappel (0,25ml) douze à vingt-quatre mois après la primovaccination (douze mois en cas d’exposition continue au risque infectieux).
Enfants et adolescents de 3 à 17 ans révolus
- 2 doses de 0,5 ml espacées de quatre semaines (J0 et J28) ;
- 1 dose de rappel (0,5 ml) douze à vingt-quatre mois après la primovaccination (douze mois en cas d’exposition continue au risque infectieux).
Pas de donnée de séroprotection à long terme.
Adultes
Adultes de 18 à 65 ans
- 2 doses de 0,5 ml espacées de quatre semaines (J0, J28) ;
- 1 dose de rappel douze à vingt-quatre mois après la primovaccination (douze mois en cas d’exposition continue au risque infectieux).
Les données de séroprotection à long terme suggèrent qu’une 2ème dose de rappel est à envisager dix ans plus tard, en cas de nouvelle exposition au risque infectieux.
En cas de départ imminent pour une zone à risque, il est possible, chez l’adulte (18-65 ans) uniquement, d’appliquer un « schéma de vaccination accéléré » en 2 injections de 0,5 ml espacées d’une semaine (J0, J7).
Adultes de plus de 65 ans :
- 2 doses de 0,5 ml espacées de quatre semaines (J0, J28).
La réponse immunitaire étant plus faible dans cette tranche d’âge, il est préférable de ne pas attendre douze mois pour effectuer la dose de rappel, en cas de nouvelle exposition au risque infectieux. Pas de données de séroprotection à long terme.
Chez les sujets n’ayant reçu qu’une seule dose en primovaccination, une protection totale contre la maladie pourrait ne pas être obtenue. Certaines données montrent, après une seconde injection administrée jusqu'à onze mois après la première, des taux élevés de séroconversion.
Il est recommandé aux personnes ayant reçu une 1re dose d'Ixiaro® de terminer le schéma de primovaccination en 2 doses avec Ixiaro®. Si le schéma vaccinal complet ne peut pas être réalisé en France avant le départ, il convient de s’assurer de la disponibilité de ce vaccin dans le pays de destination.
Le rappel devra également être réalisé avec le même vaccin.
Une dose de rappel sera administrée si une nouvelle exposition éventuelle au virus de l’encéphalite japonaise est prévue (un nouveau voyage par exemple) ou chez les personnes à risque continu d’infection par le virus de l’encéphalite japonaise (personnel de laboratoire ou personnes résidant dans une zone endémique).
Pour les personnes vaccinées antérieurement avec un schéma complet par Jevax® et à nouveau en situation d'exposition au virus, 1 dose de rappel par Ixiaro® est suffisante pour les adultes. (Recommandation hors AMM).