La réglementation européenne relative à l’autorisation de mise sur le marché (AMM) pour les médicaments à usage humain classe les vaccins dans les médicaments immunologiques. L’évaluation d’un vaccin est donc identique à celle d’un médicament.
L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) intervient à plusieurs étapes du développement, de la mise sur le marché à la surveillance des vaccins après leur mise sur le marché. Les essais cliniques effectués dans le cadre de la recherche sur les nouveaux vaccins sont soumis à autorisation de l’ANSM.
Le dossier de demande de mise sur le marché doit être présenté selon un format standard dit CTD (Common Technical Document) commun pour tous les États de l’espace économique européen, aussi bien pour les demandes évaluées dans le cadre de procédures européennes que pour les demandes nationales. Il comprend des données chimiques, pharmaceutiques et biologiques relatives aux substances actives et au produit fini. Ces données incluent notamment des informations relatives à la sécurité virale.
Phases de développement préclinique
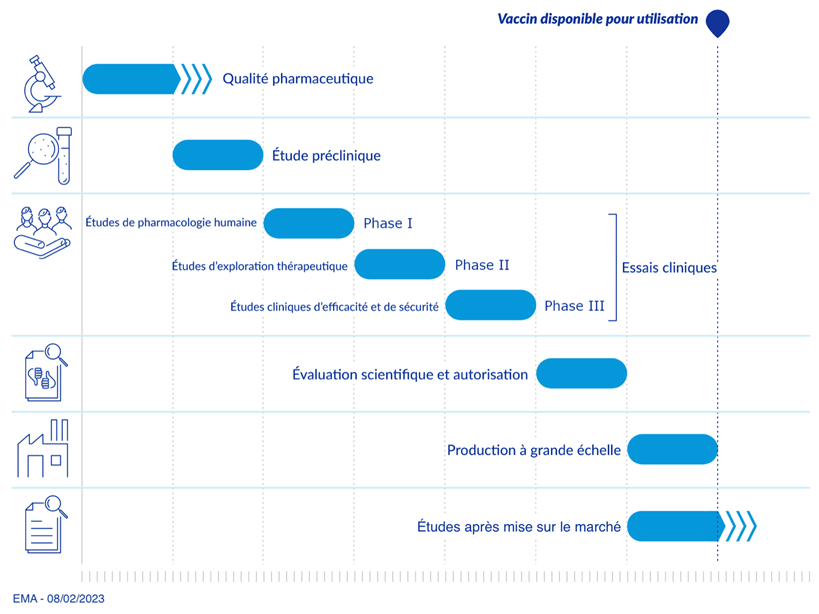
Les études cliniques réalisées chez l’homme sont précédées d’une phase de développement dite préclinique. Cette phase préclinique comprend des études in vitro et/ou in vivo, et visent à démontrer les profils pharmacologiques et toxicologiques du vaccin. Ces études réalisées chez l’animal permettent de vérifier l’immunogénicité du candidat vaccin, son innocuité et sa tolérance chez différentes espèces animales et en utilisant la même voie d’administration que celle recommandée chez l’homme. Dans certains cas, des études de reprotoxicité chez l’animal sont nécessaires, afin d’évaluer les potentiels effets du candidat vaccin au cours de périodes critiques comme la gestation.
Phases de développement clinique
Comme pour toute spécialité pharmaceutique, le développement d’un vaccin s’appuie sur des études cliniques qui se déroulent en trois phases (phases I à III). Cependant, il n’existe pas toujours de différences nettes entre ces phases, notamment pour les phases II et III.
- Les études pharmacologiques (phases I et II) évaluent notamment les caractéristiques de la réponse immune, l’interaction avec d’autres vaccins, la relation dose/réponse et le schéma de vaccination.
- L’immunogénicité et la tolérance sont évaluées au cours des phases I à III.
- L’efficacité protectrice est essentiellement évaluée au cours de la phase III.
- Les études de phase IV sont des études réalisées après la mise sur le marché du vaccin.
L’AMM ne sera délivrée qu’après une évaluation de la qualité, de l’efficacité et de la sécurité du vaccin, c’est-à-dire une appréciation du rapport bénéfice/risque.
Phases de post-commercialisation
Après sa commercialisation, les différents acteurs de l’évaluation du médicament vont vérifier (ou infirmer), en situation réelle, l’efficacité du vaccin, affiner et éventuellement étendre ou restreindre ses indications, recenser les effets indésirables et interactions médicamenteuses problématiques, quantifier leur incidence et importance en pratique réelle établissant les critères d’innocuité (« pharmacovigilance ») et finalement étudier l’ensemble des conséquences médico-économiques imputables à l’usage du vaccin.
L’ANSM veille à la sécurité d’emploi des vaccins après mise sur le marché grâce au système national de pharmacovigilance qu’elle met en œuvre et coordonne, en partenariat avec l’Agence européenne du médicament (EMA).
La pharmacovigilance reste donc une étape indispensable dans l’étude de tout médicament après sa commercialisation car il est prescrit à une population plus importante et des effets indésirables jusque-là méconnus peuvent apparaître.
Le système français de pharmacovigilance s’organise autour des centres régionaux de pharmacovigilance (CRPV). Ces structures assurent le recueil systématique des réactions indésirables post-médicamenteuses, le développement des études et enquêtes de pharmacovigilance et l’information en matière de médicament. L’activité des CRPV se développe également dans le cadre de la pharmacologie épidémiologique, afin de préciser par exemple les facteurs favorisant la survenue de tel ou tel effet indésirable.
Pour en savoir plus
- Agence nationale de sécurité du médicament et des produits de santé (ANSM). Dossier vaccins.
- Agence nationale de sécurité du médicament et des produits de santé (ANSM). Pharmacovigilance.
- Ministère des Solidarités et de la Santé. Pharmacovigilance.
- Montastruc J.L., Sommet A., Lacroix I., Olivier P., Durrieu G., Damase-Michel C., et al. La pharmacovigilance et l’évaluation du risque médicamenteux : intérêt, fonctionnement et méthodes. Revue du rhumatisme, 2006, 73 (10-11) : 1021-1024.

