Clinique
L’infection à HPV est une des trois infections sexuellement transmissibles (IST) les plus fréquentes dans la population sexuellement active : la très grande majorité des personnes ayant des relations sexuelles seront infectées par ces virus. Tout contact sexuel, avec ou sans pénétration, est associé à un risque d’infection.
Quel que soit le type de HPV considéré, la primo-infection est inapparente. Après celle-ci, la durée médiane de portage du virus est d’environ quinze mois au niveau du col de l’utérus et douze mois au niveau de l’anus. Ce portage évolue dans plus de 90% des cas vers la clairance virale.
Dans un faible pourcentage de cas, l’infection persiste, d’abord sans conséquence cytologique ou histologique, puis se traduisant par des lésions histologiques précancéreuses pour lesquelles existe une classification précise (HSIL/LSIL : lésions malpighiennes intraépithéliales de haut grade/bas grade).
Toutes ces lésions précancéreuses ont une probabilité importante (de 32 à 57% selon la lésion) de régresser spontanément, d’autant plus s’il s’agit de lésions de bas grade. Dans le cas contraire, un cancer peut se développer quinze à vingt-cinq ans après l’infection.
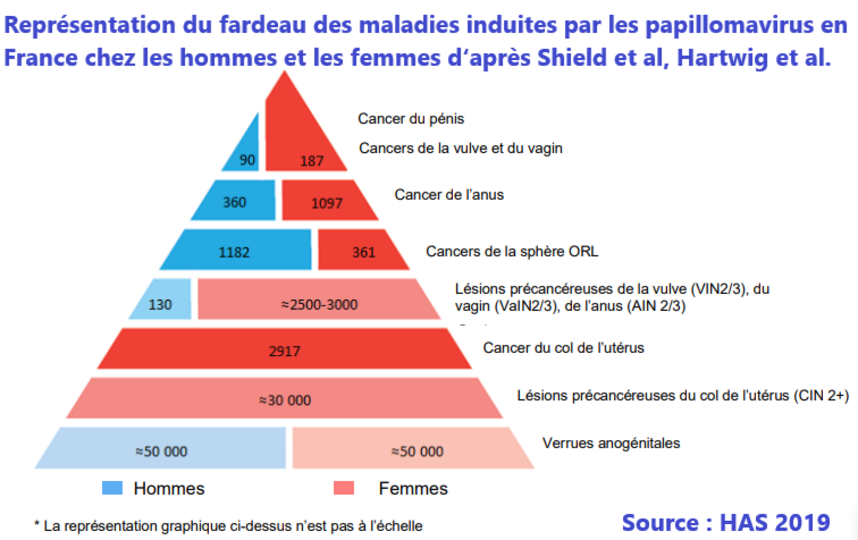
Tous les cancers du col de l’utérus et 90% des cancers de l’anus résultent ainsi d’une infection par un HPV ; les HPV 16 et 18 sont en cause dans environ 70% des cancers du col de l’utérus, et le HPV 16 dans 89 % des cancers de l’anus.
L’implication des infections à HPV, en particulier la souche HPV 16, dans l’apparition de cancer d’autres sites (la verge, la vulve, le vagin, le larynx et la sphère oro-pharyngée (oropharynx, amygdale, base de la langue)) a également été établie. Notamment, il est estimé que 35% des cancers oro-pharyngés sont attribuables aux infections HPV en France.
Les génotypes HPV inclus dans le vaccin nonavalent sont associés à environ 90% des cancers du col de l’utérus, 80% des cancers de l’anus, 55-60% des cancers du vagin, 50% des cancers de la verge, 40% des cancers de la vulve (données mondiales).
Les condylomes (verrues ano-génitales ou végétations vénériennes), sont dus à l’infection par des HPV à faible risque oncogène, le plus souvent les types 6 et 11. Ces deux types sont responsables de 90% des condylomes génitaux. La transmission sexuelle des condylomes ano-génitaux est bien documentée. Elle nécessite un dépistage des partenaires sexuels et la recherche d’autres maladies sexuellement transmissibles associées. Le délai entre l’acquisition de l’infection HPV et l’apparition des condylomes acuminés est, en moyenne, de trois mois (trois semaines à huit mois). Les condylomes ano-génitaux sont des lésions fréquentes souvent récidivantes après traitement, et pouvant retentir sur la vie sexuelle et psychoaffective même si elles sont considérées comme bénignes.
Epidémiologie/Couverture vaccinale
Epidémiologie
On estime que près de 80% des adultes ont au moins une infection à HPV dans leur vie. Plus de 60% des primo-infections surviennent dans les cinq ans suivant les premiers rapports sexuels.
En 2014, la probabilité d'être infecté par un virus HPV avait été estimée à 85% chez les femmes et 91% chez les hommes.
Une métanalyse parue en 2023 a montré que près d’un homme sur trois dans le monde est infecté par au moins un type de virus HPV à tropisme génital et qu'environ un homme sur cinq est infecté par un ou plusieurs types de HPV. La prévalence du HPV est élevée chez les hommes de plus de 15 ans. Les hommes sexuellement actifs, quel que soit leur âge, constituent un réservoir important d'infection génitale au HPV.
L’incidence annuelle des condylomes ano-génitaux est très élevée et en augmentation dans les pays développés depuis trente ans.
Le cancer du col de l’utérus est, en France, le 12ème cancer féminin pour le nombre de cas incidents, avec environ 3000 nouveaux cas et environ 1100 décès chaque année. C’est un cancer de relativement bon pronostic même si celui-ci se dégrade avec un taux de survie à 5 ans de 63% pour la période 2010/2015 ; ce taux était de 68% sur la période 1989/1993. Cette baisse est un effet « paradoxal » du dépistage sur la survie : grâce au dépistage permettant un diagnostic et un traitement au stade précoce de lésions précancéreuses, les cancers sont désormais détectés à un stade plus avancé (chez des femmes non dépistées), entrainant une baisse mécanique du taux de survie.
Le cancer de l’anus est un autre cancer fréquent lié au HPV, dont l’incidence est en augmentation. Environ 2000 cas (dont 75 % chez les femmes) sont maintenant diagnostiqués chaque année. Ce cancer peut affecter les hommes et les femmes, avec un risque plus élevé pour les personnes vivant avec le VIH, les hommes ayant des relations sexuelles avec les hommes et les patients ayant eu une transplantation d’organe solide.
Couverture vaccinale
Chez les jeunes filles, la vaccination a été recommandée et introduite dans le calendrier vaccinal en décembre 2006.
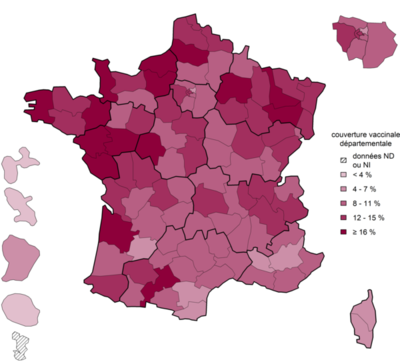
Le taux de couverture vaccinale progresse régulièrement mais reste insuffisant ; en 2022, il était de 47,8% pour une dose chez les filles âgées de 15 ans et 41,5% pour le schéma complet chez les filles âgées de 16 ans. Les estimations départementales montrent que les jeunes filles sont globalement moins bien vaccinées au sud de la Loire qu’au nord. Les couvertures sont très faibles dans les DROM.
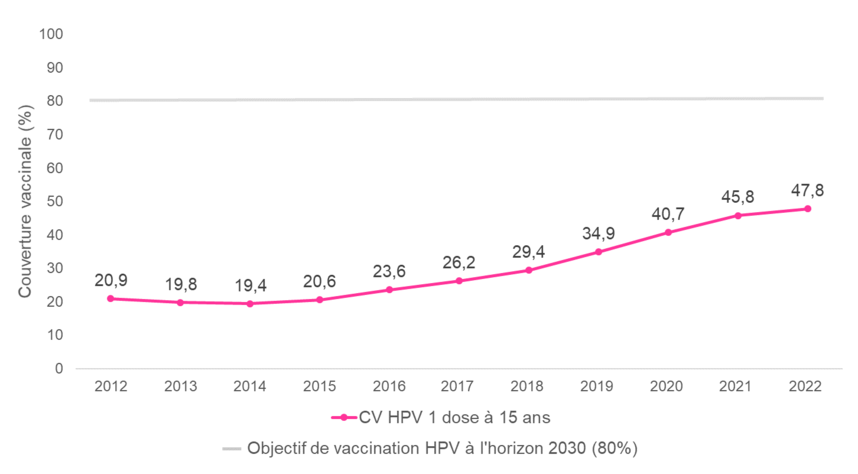
Chez les garçons, la vaccination est recommandée depuis le 1er janvier 2021. En 2022, la couverture vaccinale 1 dose à 15 ans pour les garçons était de 12,8%. La couverture vaccinale 2 doses à 16 ans (schéma complet) était de 8,5%.
Les couvertures vaccinales contre les infections à Papillomavirus chez le garçon restent particulièrement faibles dans les DROM (moins de 5% pour la première dose pour chacun des territoires) ainsi qu’en Corse (5,8%) et en Provence Alpes Côte d’Azur (9,3%).
Impact de la campagne de vaccination 2023-2024 en milieu scolaire
En 2023, selon les dernières estimations fournies par Santé publique France, plus de 100 000 élèves en classe de cinquième ont été vaccinés et plus de 300 000 adolescents du même âge ont été vaccinés en ville. Ainsi, près de 420 000 adolescents de 12 ans (48 %) ont reçu une première dose de vaccin contre les HPV au collège ou en ville. Cette première campagne a permis une amélioration importante de la couverture vaccinale chez les adolescents de 12 ans, avec une progression de 17 points entre 2022 et 2023 pour atteindre 48 % (55 % pour les filles et 41 % pour les garçons).
De même, la couverture vaccinale contre les infections à papillomavirus a connu une progression inédite chez les jeunes à partir de 15 ans. En 2023, elle est de 55 % pour une dose chez les jeunes filles âgées de 15 ans (vs 48 % en 2022), soit une augmentation de 7 points. Chez les jeunes garçons, la vaccination contre les infections à HPV est recommandée depuis 2021. La couverture vaccinale en 2023 est de 26 % pour une dose à 15 ans (vs 13 % en 2022), soit une augmentation de 13 points.




