RECOMMANDATIONS GÉNÉRALES
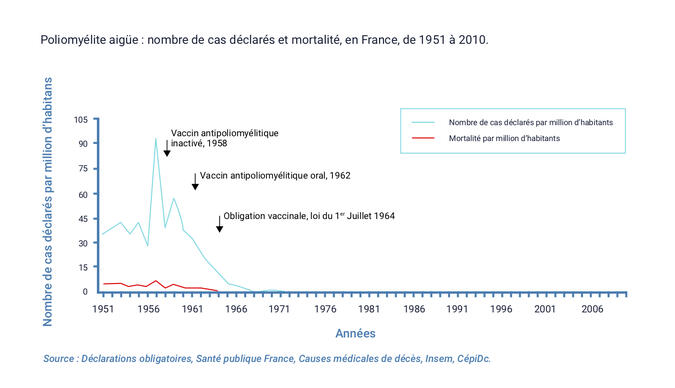
Le vaccin inactivé a été introduit dans le calendrier vaccinal français en 1958, et le vaccin oral en 1962. La vaccination a été rendue obligatoire en juillet 1964. Les deux vaccins ont été utilisés avec une prédominance pour le vaccin oral au cours des années soixante-dix. Depuis 1982, année durant laquelle plusieurs cas de poliomyélite liés à la vaccination orale ont été déclarés, le vaccin inactivé a été recommandé par la direction générale de la Santé pour éviter les accidents paralytiques. L’utilisation du vaccin oral est réservée aux situations épidémiques et il n’est plus disponible pour la vaccination de routine.
La primovaccination des nourrissons est obligatoire avec une dose à 2 et 4 mois et un rappel à 11 mois. Les rappels de l’enfant et de l’adulte sont nécessaires tout au long de la vie.
Les rappels de l'adulte sont recommandés aux âges fixes de 25 ans, 45 ans et 65 ans, puis à 75 ans, 85 ans, etc (intervalle de dix ans à partir de 65 ans, compte tenu d'une moins bonne réponse vaccinale). Le vaccin utilisé pour ces rappels inclura l’antigène coquelucheux à dose réduite ainsi que l'anatoxine diphtérique à dose réduite, l'anatoxine tétanique et les antigènes poliomyélitiques (vaccin dTcaPolio).
Les personnes nées avant 1934 peuvent ne pas avoir été vaccinées et aucune occasion ne doit être manquée de les vacciner au cours de leur vie adulte avec le vaccin inactivé.
RECOMMANDATIONS CHEZ LES VOYAGEURS
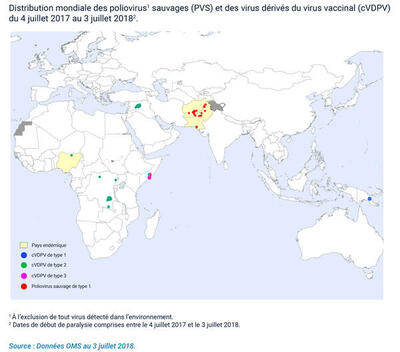
Une mise à jour des vaccinations contre la diphtérie, le tétanos et la poliomyélite est indispensable pour tous les voyageurs à destination de zones d’endémicité. Chez les expatriés et les voyageurs lors de séjour de plus de 4 semaines à destination des États où circulent les poliovirus sauvages et les poliovirus dérivés de souches vaccinales :
- si la dernière dose de vaccin poliomyélitique date de plus d’un an : 1 dose de rappel est nécessaire (vaccin monovalent ou combiné pour mise à jour selon le calendrier vaccinal en vigueur) ;
- si le séjour doit durer plus de 12 mois, un 2e rappel peut être exigé dans le cadre du Règlement sanitaire international (RSI) lorsque le voyageur quitte le pays et doit être fait au moins 1 mois avant son départ. Cette vaccination étant soumise au RSI, elle doit être attestée par un Certificat International de Vaccination, conforme au modèle figurant à l’annexe 6 du RSI.
RECOMMANDATIONS PROFESSIONNELLES
L’article L. 3111-4 du code de la santé publique prévoit l’obligation d’immunisation contre la poliomyélite – tout comme contre l’hépatite B, la diphtérie, le tétanos – de certaines catégories professionnelles :
- tout élève ou étudiant d’un établissement préparant à l’exercice de certaines professions médicales ou paramédicales. La liste des filières de formation concernées est fixée par l’arrêté du 6 mars 2007 ;
- les personnels exposés exerçant une activité dans des établissements ou organismes publics ou privés de prévention ou de soins listés par l’arrêté du 15 mars 1991 (modifié par arrêté le 29 mars 2005). Le médecin du travail apprécie individuellement l’exposition au risque de contamination des personnels concernés en fonction des caractéristiques du poste occupé et évalue, au cas par cas, l’indication de l’obligation vaccinale [arrêté du 2 août 2013].
Professionnels concernés par les rappels obligatoires du vaccin contre la diphtérie, le tétanos, la coqueluche et la poliomyélite (DTCaP).
Professionnels concernés |
Vaccination diphtérie, tétanos, coqueluche, poliomyélite (DTCaP) |
|---|---|
Étudiants des professions médicales, paramédicales ou pharmaceutiques. |
Obligatoire |
Professionnels des établissements ou organismes de prévention et/ou de soins* dont les services communaux d’hygiène publique. |
Obligatoire |
Personnels des laboratoires d’analyses médicales exposés au risque de contamination : manipulant du matériel contaminé ou susceptible de l'être. |
Obligatoire |
Personnels de laboratoire exposés au virus de la fièvre jaune. |
Obligatoire |
Personnels des entreprises sanitaires. |
Obligatoire |
Personnels des services de secours et d’incendie (SDIS). |
Obligatoire |
Personnels des entreprises de pompes funèbres, des entreprises de transports de corps avant mise en bière, en lien avec des établissements de prévention ou de soins. |
Obligatoire |
Personnels des établissements et services pour l’enfance et la jeunesse handicapée. |
Obligatoire |
Personnels des établissements et services d’hébergement pour adultes handicapés. |
Obligatoire |
Personnels des établissements et services d’hébergement pour personnes âgées. |
Obligatoire |
Personnels des services de maintien à domicile pour personnes âgées. |
Obligatoire |
Personnels des établissements de garde d’enfants d’âge préscolaire (crèches, haltes-garderies, etc.). |
Obligatoire |
Personnels des établissements et services sociaux concourant à la protection de l’enfance (dont les pouponnières). |
Obligatoire |
Personnels des blanchisseries en lien avec des établissements. |
Obligatoire |
Militaires |
Obligatoire |
* Arrêté du 15 mars 1991 modifié par arrêté le 29 mars 2005.
Télécharger et imprimer ce tableau
RECOMMANDATIONS EN CAS D’ÉPIDÉMIE
Après un cas ou une suspicion de cas de poliomyélite à virus sauvage, la mise à jour du statut vaccinal à l’aide du vaccin inactivé doit être réalisée pour toutes les personnes vivant dans l’entourage. La vaccination complète doit être administrée aux personnes jamais vaccinées ou dont le statut est inconnu.