Clinique
Le méningocoque est une bactérie strictement humaine, sujette à de fréquentes variations génétiques par transformation et recombinaison. Ces phénomènes génèrent de nouveaux variants antigéniques qui peuvent entraîner l'émergence de souches épidémiques.
Cette bactérie se présente le plus souvent comme une espèce commensale du rhinopharynx. On estime que 5 à 10% de la population sont porteurs asymptomatiques de méningocoque. Le taux de portage varie avec l’âge. Une méta-analyse a permis d’estimer le taux en fonction de l’âge : il passait de 4,5% chez les enfants, à 23,7% chez les jeunes adultes âgés de 19 ans, et diminuait ensuite pour atteindre 7,8% chez les personnes âgées de 50 ans et plus. Si l’acquisition d’un méningocoque conduit le plus souvent à un portage asymptomatique, elle est rarement suivie d’une infection invasive à méningocoque.
Celle-ci peut se produire notamment lors de l’acquisition de souche hyper-invasive. La réceptivité de l’hôte (immaturité immunitaire du petit nourrisson ou facteurs d’immunosuppression) et une infection virale récente des voies aériennes (grippe) jouent également un rôle majeur dans la survenue d’une IIM.
Le méningocoque possède une capsule polyosidique qui détermine son sérogroupe. Parmi les douze sérogroupes décrits, les sérogroupes A, B, C, X, Y et W sont responsables de la majorité des IIM. Dans les pays industrialisés, les IIM surviennent majoritairement sous forme de cas sporadiques, parmi lesquels prédominent les sérogroupes B, C, W et Y.
Formes cliniques principales d’infections invasives méningococciques
-
La méningite, la forme clinique la plus fréquente.
- Le diagnostic est facile lorsque l’on est en présence : d’un syndrome infectieux avec fièvre à début brutal, céphalées, vomissements et photophobie. Le purpura, la raideur méningée et l’altération de la conscience apparaissent plus tardivement.
- Le diagnostic est plus difficile chez le nourrisson où seuls 32% des enfants de moins d'un an présentent une raideur de la nuque ; cette raideur de nuque est parfois remplacée par une hypotonie axiale. Les éléments cliniques évocateurs sont : le caractère grognon, les geignements, les troubles de la conscience, un comportement inhabituel ou un refus de l’alimentation. Chez le nourrisson le bombement de la fontanelle est associé à une forte probabilité de méningite.
-
Les méningococcémies qui ne sont pas obligatoirement associées à des méningites. Les méningococcémies peuvent se compliquer de chocs septiques foudroyants et réaliser un tableau de Purpura fulminans (1/4 des IIM environ). Ce purpura se caractérise par la présence de taches qui s’étendent rapidement en taille et en nombre, avec au moins un élément nécrotique ou ecchymotique de plus de trois millimètres de diamètre associé à un syndrome infectieux sévère, non attribué à une autre étiologie. Il existe une altération de l'état général ainsi que des troubles digestifs (vomissements, douleurs abdominales et de la circulation périphérique). L’état de choc témoigne de l’extrême gravité de ce syndrome.
Le purpura peut être précédé voire remplacé par une éruption d'allure maculopapuleuse.
Certains signes précoces de sepsis sont fréquemment retrouvés: douleurs aux jambes, refus de marcher, troubles de la température et de la coloration des extrémités ou encore angoisse chez l’adolescent.
Même en cas de prise en charge précoce, ces infections peuvent conduire au décès ou laisser des séquelles importantes.
Des localisations extra-méningées plus rares doivent être connues et recherchées, comme les arthrites (septiques ou réactionnelles), endophtalmies, urétrites, péricardites, myocardites, tamponnade, épiglottes, pleurésies, pneumonies invasives confirmées par la découverte d’une bactériémie, formes abdominales (douleurs abdominales, nausées, vomissements, diarrhées voire tableau pseudo chirurgical).
Pronostic
Les IIM entraînent, dans 10 à 20% des cas, des séquelles définitives à type de nécrose cutanée (10%) avec ou sans amputation, de déficit du neuro-développement (7% des cas), de surdité (4% des cas), d’épilepsie, de troubles visuels.
La létalité est de 10 à 12% en France.
Épidémiologie
L’incidence des IIM connaît une distribution bimodale avec deux pics distincts : l’un au cours des premières années de vie, et l’autre au moment de l’adolescence, en lien respectivement avec l’immaturité immunitaire et l’augmentation du taux de portage.
Les cas surviennent la plupart du temps sous forme sporadique. Une diversité clonale est observée parmi les souches circulantes. Des foyers de cas peuvent survenir dans la population ou au sein de collectivités en lien avec des souches appartenant à des complexes clonaux hyper invasifs.
La surveillance des IIM repose sur la déclaration obligatoire (DO) et la caractérisation des souches par le Centre national de référence (CNR) des méningocoques.
Les IIM affectent en majorité les nourrissons, les jeunes enfants et les jeunes adultes (15-24 ans). La majorité des cas sont sporadiques. Les cas secondaires représentent 1 à 2% de l’ensemble des cas déclarés. Environ un tiers des cas secondaires surviennent dans le milieu familial, un tiers en milieu scolaire et le dernier tiers dans des contextes variés (groupe d’amis, université, EHPAD, fréquentation d’une soirée/fête commune, etc). La létalité des IIM est de 10 à 12%. Il existe des variations annuelles dans l’incidence des IIM par sérogroupe.
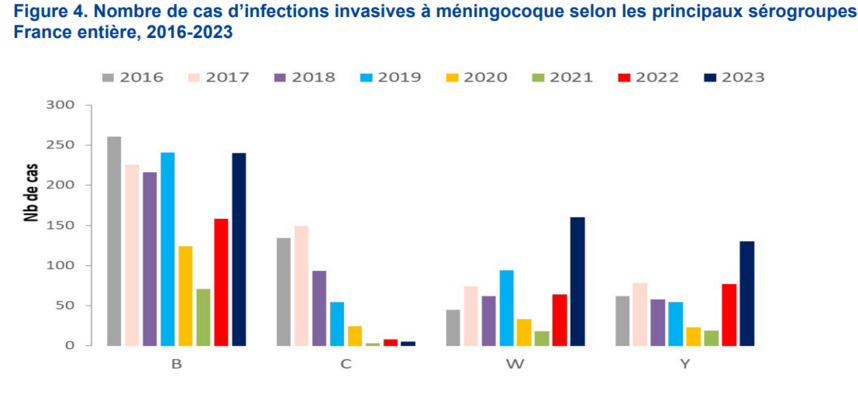
En 2023, 560 cas d’IIM ont été déclarés, soit une augmentation de 72 % par rapport à 2022. Le taux d’incidence des cas déclarés des IIM en 2023 était de 0,82 / 100 000 personnes. Ce taux était équivalent à celui relevé en 2016 et 2017, et un peu plus élevé que celui observé en 2018 et 2019. Des changements notables dans l’épidémiologie des IIM ont été observés en 2023 par rapport à la période pré-pandémique avec des tendances différentes en fonction du sérogroupe.
La part des sérogroupes parmi l’ensemble des cas est la suivante : B (44% des cas), C (0,9%), W (29%), Y (24%).
Le nombre de cas déclarés d’IIM B était équivalent au niveau relevé avant la pandémie, tandis que les IIM W et Y ont très fortement augmenté en comparaison avec la période 2016-2019 (+133 % pour les IIM W, +106 % pour les IIM Y) (Figure 4). Le nombre de cas et le taux d’incidence des IIM W et Y ont atteint des niveaux qui n’avaient jamais été observés auparavant. Concernant les IIM C, le nombre de cas était très faible comme observé depuis 2021 (Données de Santé publique France).
L’évolution de l’épidémiologie est détaillée sur le site de Santé Publique France
Couverture vaccinale contre le méningocoque C
La couverture vaccinale actuelle contre le méningocoque C est en progression régulière, avec une accélération depuis l'obligation de vaccination de nourrissons nés depuis le 1er janvier 2018. Ce sont les adolescents et les jeunes adultes qui présentent les couvertures vaccinales les plus faibles (voir tableau ci-dessous), alors que le risque d’IIM C est élevé dans ces tranches d’âge et que leur immunisation est essentielle à l’établissement d’une immunité de groupe.
Tableau. Couverture vaccinale contre le méningocoque C, en France, au 31 décembre 2022.
Âges |
Couverture vaccinale |
2-4 ans |
85% |
5-9 ans |
79% |
10-14 ans |
69% |
15-19 ans |
44% |
20-24 ans |
29% |