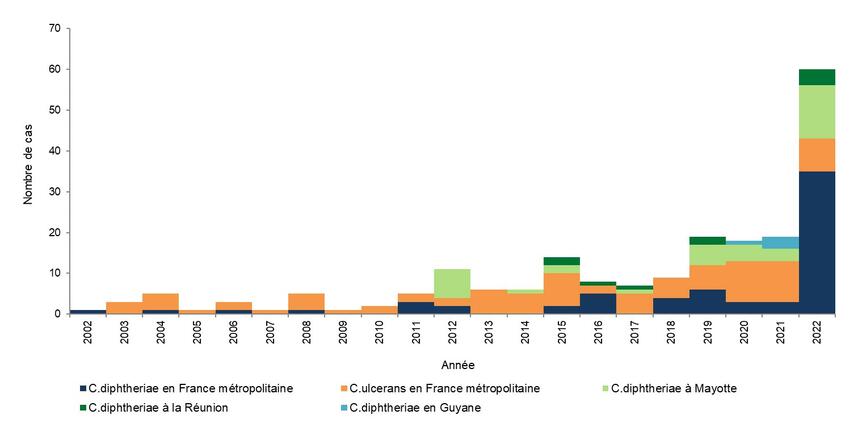
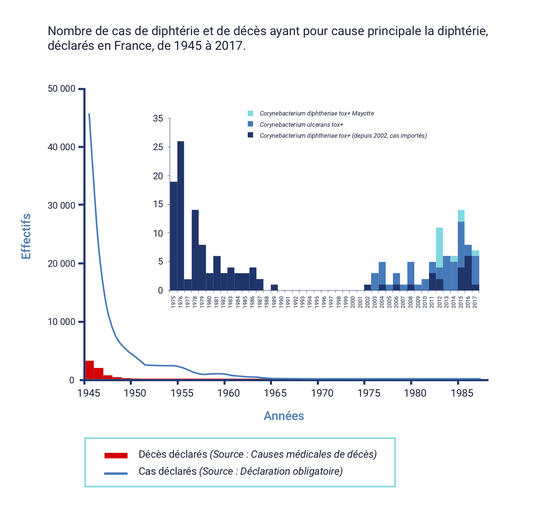
Les vaccinations contre la diphtérie sont réalisées avec des vaccins combinés comportant une dose entière de vaccin diphtérique (D) chez les nourrissons et chez l’enfant de 6 ans. La vaccination des nourrissons est pratiquée avec un vaccin combiné hexavalent DTCaPolioHib-HBV. La primo vaccination comporte deux injections à l’âge de 2 mois (8 semaines) et 4 mois, suivies d’un rappel à l’âge de 11 mois. Ce schéma ne doit pas être différé.
Les vaccinations de rappel chez l’enfant à partir de 11 ans, puis chez l’adulte, sont réalisées avec des vaccins combinés comportant une dose réduite de vaccin diphtérique (d).
Les rappels de l'adulte sont recommandés aux âges fixes de 25 ans, 45 ans et 65 ans, puis à 75 ans, 85 ans, etc (intervalle de dix ans à partir de 65 ans, compte tenu d'une moins bonne réponse vaccinale). Le vaccin utilisé pour ces rappels inclura l’antigène coquelucheux à dose réduite ainsi que l'anatoxine diphtérique à dose réduite, l'anatoxine tétanique et les antigènes poliomyélitiques (vaccin dTcaPolio).
RECOMMANDATIONS GÉNÉRALES
Nourrissons et enfants (jusqu’à 13 ans)
- La primovaccination obligatoire des nourrissons comporte 2 injections à l’âge de 2 mois (8 semaines) et 4 mois, suivies d’un rappel à l’âge de 11 mois. La vaccination sera réalisée avec un vaccin hexavalent (valence D).
- Rappel recommandé à 6 ans : 1 dose de vaccin DTcaP.
- Rappel recommandé entre 11 et 13 ans : 1 dose de vaccin combiné dTcaP.
Adultes
- Rappel à 25 ans : 1 injection de vaccin combiné DTCaP.
- Rappel à 45 ans : 1 injection de vaccin combiné DTCaP.
- Rappel à 65 ans : 1 injection de vaccin combiné DTCaP, puis un rappel tous les dix ans.
Si le schéma a été interrompu, il faut le reprendre là où il a été arrêté. Il n’est pas nécessaire de tout recommencer.
RECOMMANDATIONS PARTICULIÈRES
Les professionnels de santé
Les professionnels de santé sont soumis à l’obligation vaccinale définie par l’article L. 3111-4 du code de la santé publique. Les rappels sont effectués aux mêmes âges fixes que la population générale (25 ans, 45 ans et 65 ans, en fonction de la poursuite des activités professionnelles), avec un vaccin contenant l'antigène coquelucheux, une dose réduite d’anatoxine diphtérique et tétanique (DTCaP).
Pour plus d’information, consultez le texte spécifique sur les vaccinations des professionnels de santé.
Autres professionnels
La vaccination est aussi obligatoire pour :
Professionnels concernés |
Vaccination diphtérie, tétanos, poliomyélite, coqueluche (DTCaP) |
|---|---|
Étudiants des professions médicales, paramédicales ou pharmaceutiques. |
Obligatoire |
Professionnels des établissements ou organismes de prévention et/ou de soins* dont les services communaux d’hygiène publique. |
Obligatoire |
Personnels des laboratoires d’analyses médicales exposés au risque de contamination : manipulant du matériel contaminé ou susceptible de l'être. |
Obligatoire |
Personnels de laboratoire exposés au virus de la fièvre jaune. |
Obligatoire |
Personnels des entreprises sanitaires. |
Obligatoire |
Personnels des services de secours et d’incendie (SDIS). |
Obligatoire |
Personnels des entreprises de pompes funèbres, des entreprises de transports de corps avant mise en bière, en lien avec des établissements de prévention ou de soins. |
Obligatoire |
Personnels des établissements et services pour l’enfance et la jeunesse handicapée. |
Obligatoire |
Personnels des établissements et services d’hébergement pour adultes handicapés. |
Obligatoire |
Personnels des établissements et services d’hébergement pour personnes âgées. |
Obligatoire |
Personnels des services de maintien à domicile pour personnes âgées. |
Obligatoire |
Personnels des établissements de garde d’enfants d’âge préscolaire (crèches, haltes-garderies, etc.). |
Obligatoire |
Personnels des établissements et services sociaux concourant à la protection de l’enfance (dont les pouponnières). |
Obligatoire |
Personnels des blanchisseries en lien avec des établissements. |
Obligatoire |
Militaires |
Obligatoire |
Voyageurs
Un rattrapage vaccinal est recommandé à tous les voyageurs non à jour de leurs vaccinations à destination de zones d’endémicité.
Personnes en contact étroit avec un cas de diphtérie
Tous les contacts proches considérés comme exposés doivent recevoir une dose d’un vaccin contenant la valence à dose entière D pour les enfants ou la valence à dose réduite d pour les adultes, sauf s’il est possible de documenter un antécédent de primovaccination d’au moins trois doses et un dernier rappel datant de moins de cinq ans. Les sujets non ou incomplètement vaccinés recevront ultérieurement les doses additionnelles pour compléter le schéma vaccinal.
Les « contacts » doivent également recevoir un traitement prophylactique par antibiotiques (amoxicilline ou macrolides si allergie), quel que soit leur statut vaccinal. Les modalités de traitement des contacts diffèrent selon que l’infection est à C. diphtheriae ou C. ulcerans et C. tuberculosis.
Pour plus d’information, consultez l’avis du Haut Conseil de la santé publique (HCSP) relatif à la conduire à tenir lors de l’apparition d’un cas de diphtérie.