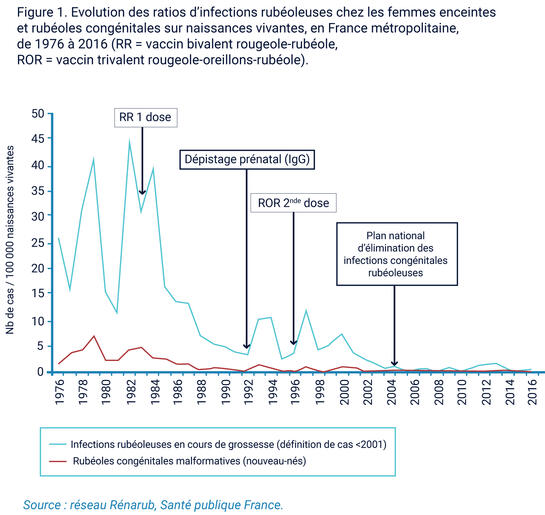
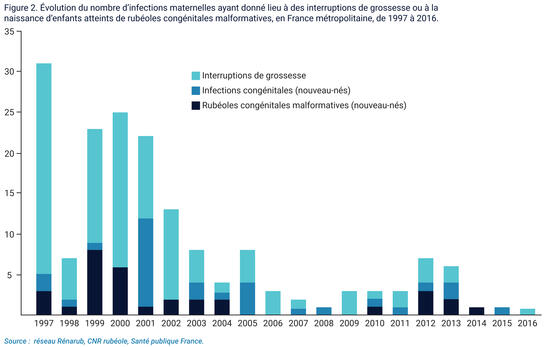
La stratégie actuelle de vaccination a pour objectifs d’empêcher la contamination de la femme enceinte, mais également d’éliminer la circulation du virus chez les enfants. En effet, la vaccination contre la rubéole a d’abord été instaurée dans les années soixante-dix dans la plupart des pays industrialisés de manière sélective chez les filles pré-pubères, afin de prévenir la survenue des infections chez les femmes enceintes. La surveillance épidémiologique ainsi que les résultats des travaux de modélisation mathématique ont montré l’impossibilité d’éliminer la rubéole congénitale à travers cette seule approche. La survenue persistante d’infections durant la grossesse était due à la poursuite de la circulation virale chez les enfants et dans la population masculine, couplée à une proportion résiduelle, même très faible, de femmes enceintes non immunes, de par les échecs vaccinaux et l’impossibilité d’atteindre une couverture de 100% des jeunes filles.
C’est pourquoi tous les pays ayant intégré dans leur calendrier vaccinal la vaccination contre la rubéole ont adopté, à la fin des années quatre-vingt, une stratégie de vaccination des nourrissons des deux sexes. Cependant, ces mêmes modèles mathématiques ont montré le danger de cette stratégie en cas de couverture vaccinale insuffisante chez le nourrisson : en réduisant la circulation virale sans l’interrompre, elle pourrait avoir comme effet d’élever l’âge moyen des cas résiduels et par là-même d’augmenter le risque que ces cas surviennent chez des femmes en âge de procréer.
La rubéole fait l’objet d’un plan OMS d’élimination dans la région Europe. L’augmentation de la couverture vaccinale à deux doses des enfants avant l’âge de 2 ans (qui doit atteindre au moins 95% pour les deux doses), l’administration plus précoce de la seconde dose, et le rattrapage des sujets réceptifs (adolescents et jeunes adultes nés depuis 1980) devraient permettre à terme l’interruption de la transmission de la rougeole et de la rubéole.
RECOMMANDATIONS GÉNÉRALES
Tous les enfants, à l’âge de 18 mois, devraient avoir reçu deux doses du vaccin trivalent contre la rougeole, les oreillons et la rubéole. La première dose est administrée à 12 mois, quel que soit le mode de garde, et la seconde dose entre 16 et 18 mois.
La vaccination contre la rubéole est obligatoire pour tous les enfants nés à partir du 1er janvier 2018. Elle est exigée pour l’entrée ou le maintien en collectivité depuis le 1er juin 2018.
Les personnes nées depuis 1980 devraient avoir reçu au total deux doses de vaccin trivalent, en respectant un délai minimum d’un mois entre les deux doses, quels que soient les antécédents vis-à-vis des trois maladies. D’une part, en effet, le fait d’avoir présenté l’une de ces maladies ne protège pas contre les deux autres et, d’autre part, administrer un vaccin vivant atténué à une personne déjà immunisée ne présente aucun inconvénient (le virus vaccinal sera simplement inactivé par les anticorps préexistants).
Les femmes nées avant 1980 non vaccinées contre la rubéole et ayant un projet de grossesse doivent recevoir une dose de vaccin trivalent (rougeole, oreillons, rubéole). Cette vaccination peut, par exemple, être pratiquée lors d’une consultation de contraception. Il n’est pas nécessaire de réaliser de sérologie prévaccinale pour déterminer l’existence d’une immunité ; cependant, si les résultats d’une sérologie confirmant l’immunité de la femme vis-à-vis de la rubéole sont disponibles, il n’est pas utile de la vacciner. Enfin, il n’est pas nécessaire de réaliser de contrôle sérologique après vaccination ; et il n’y a pas lieu de revacciner des femmes ayant déjà reçu deux vaccinations préalables, quel que soit le résultat de la sérologie si elle a été pratiquée.
Pour les femmes enceintes dont la sérologie prénatale est négative ou inconnue, ou celles qui n’ont pas reçu deux doses de vaccin trivalent ROR, la vaccination ne pouvant être pratiquée pendant la grossesse, elle devra être pratiquée immédiatement après l’accouchement, de préférence avant la sortie de la maternité, ou à défaut, au plus tôt après la sortie, même en cas d’allaitement (en l’absence d’immunodéficience suspectée ou confirmée chez l’enfant).
La vaccination contre la rougeole et la rubéole est contre-indiquée pendant la grossesse ; cependant, une vaccination réalisée par inadvertance chez une femme enceinte ne doit pas être un motif d’interruption de grossesse. La grossesse doit être évitée dans le mois suivant la vaccination : il convient de conseiller aux femmes ayant l’intention de débuter une grossesse de différer leur projet.
La souche virale atténuée utilisée dans le vaccin ne peut pas être transmise d’un sujet vacciné à un sujet non immun. Il n’y a donc pas de risque de transmission entre un vacciné récent et une femme enceinte.
EN MILIEU PROFESSIONNEL
Les personnes nées avant 1980, non vaccinées et sans antécédent connu de rougeole ou de rubéole, qui exercent des professions de santé (en formation, à l’embauche ou en poste) doivent recevoir une dose de vaccin trivalent rougeole-oreillons-rubéole. La vaccination avec une dose de vaccin trivalent ROR est d’autant plus recommandée pour les personnes travaillant dans les services accueillant des patients à risque de rougeole grave (immunodéprimés).
Les professionnels travaillant au contact des enfants doivent aussi recevoir une dose de vaccin trivalent rougeole-oreillons-rubéole.
Pour l’ensemble de ces personnels, lorsque les antécédents de vaccination ou de maladie (rougeole, rubéole) sont incertains, la vaccination peut être pratiquée sans contrôle sérologique préalable.
Les obligations et recommandations vaccinales des professionnels sont amenées à évoluer. Les professionnels seront informés de la mise en oeuvre lorsque les textes législatifs et réglementaires seront publiés.
SCHÉMA DE VACCINATION
Nourrissons
- 1 dose du vaccin contre la rougeole, les oreillons et la rubéole à l’âge de 12 mois (co-administration possible avec le vaccin contre les infections invasives à méningocoque C en deux sites d'injection différents) ;
- et une 2ème dose entre 16 et 18 mois.
Les nourrissons ayant reçu une dose de vaccin trivalent ROR avant l’âge de 12 mois quelle qu’en soit la raison, doivent recevoir 2 doses additionnelles de vaccin trivalent contre la rougeole, les oreillons et la rubéole (vaccin ROR) : 1ère dose additionnelle à l’âge de 12 mois, puis 2nde dose additionnelle donnée à l’âge de 16-18 mois, en respectant un intervalle minimal d’un mois entre les doses, soit un schéma vaccinal de trois doses au total.
Personnes nées depuis 1980 et âgées de plus de 18 mois
- rattrapage pour obtenir, au total, 2 doses de vaccin trivalent ROR (voire trois doses pour les personnes ayant initié leur vaccination avant l’âge de 12 mois), quels que soient les antécédents vis-à-vis des trois maladies.